Укажите ряд, в котором приведены формулы двух сложных и одного простого вещества:
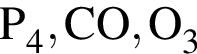
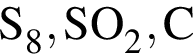
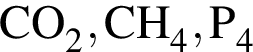
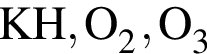
Укажите ряд, в котором приведены формулы двух сложных и одного простого вещества:
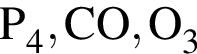
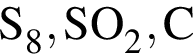
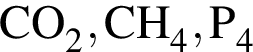
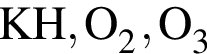
Электронная конфигурация атома 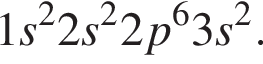 Число энергетических уровней, занятых электронами в атоме, равно:
Число энергетических уровней, занятых электронами в атоме, равно:
Наименьшее число протонов содержится в ядре атома, название которого:
Согласно положению в периодической системе наибольшее значение электроотрицательности имеет химический элемент с порядковым номером:
Укажите пару веществ, молярные объёмы которых одинаковы (н. у.):
Установите соответствие между формулой вещества и степенью окисления в нем атома химического элемента,указанного в скoбках.
1) OF2(O)
2) NH4Cl(N)
3) KHCO3(C)
a) –3
б) –2
в) +2
г) +3
д) +4
Образец железной руды массой 100 г состоит из оксида железа(III) и не содержащих железо примесей. Массовая
доля железа в образце равна 67,8 %. Масса (г) оксида железа(III) в данном образце составляет:
Простое вещество, в реакции с которым водород является окислителем:
Укажите правильное утверждение относительно азота и фосфора:

Бокситы — это природные соединения:
Водный раствор метилоранжа становится красным при пропускании в него газов:
а) ![]()
б) ![]()
в) ![]()
г) ![]()
Основания образуются в результате превращений:
а — 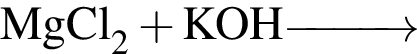
б — 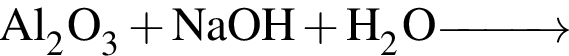
в — 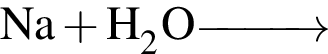
г — 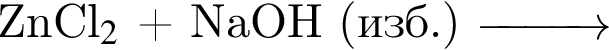
Используя в качестве реагента только разбавленную серную кислоту, в одну стадию можно осуществить превращение:


Относительно вещества, формула которого 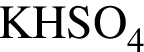 верно:
верно:
а — получают в реакции 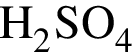 и
и ![]() (изб.)
(изб.)
б — относится к кислым солям
в — реагирует с гидроксидом калия
г — имеет название гидросульфат калия
Для кислорода и озона совпадает:
Укажите правильные утверждения относительно азота:
а) в молекуле имеется кратная связь
б) в природе встречается в составе как простого, так и сложных веществ
в) используется для создания инертной среды
г) объёмная доля в воздухе составляет 21%
Установите соответствие между формулой вещества и его характеристикой.
1 — ![]()
2 — 
3 — 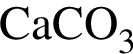
4 — ![]()
а — является основным компонентом мрамора
б — применяется в качестве сухого льда для хранения скоропортящихся продуктов
в — служит восстановителем металлов в металлургии
г — используется в пищевой промышленности
д — является основным компонентом гипса
Выберите правильное утверждение:
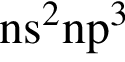
Укажите верное утверждение относительно 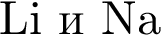 :
:
Разбавленная серная кислота реагирует с веществами (электролиты взяты в виде водных растворов):
а — 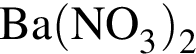
б — ![]()
в — ![]()
г — ![]()
Гидроксид алюминия является конечным продуктом схемы превращений:
а) 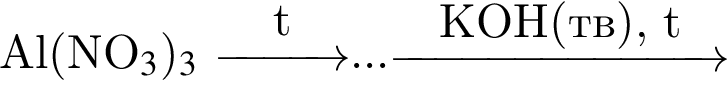
б) 
в) 
г) 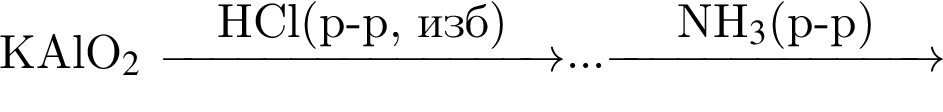
О протекании химических процессов в водном растворе свидетельствует:
Число возможных попарных взаимодействий в разбавленном водном растворе между ионами 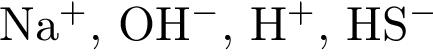 равно:
равно:
В водном растворе в значительных количествах совместно могут находиться ионы пары:
Какая масса (г) меди должна прореагировать с серной кислотой, чтобы выделившийся газ занял такой же объём, как и газ, выделяющийся при действии избытка разбавленной серной кислоты на железо массой 0,168 г? Объёмы газов измерены при одинаковых условиях.
При добавлении к воде оксида стронция:
а) рН увеличивается;
б) рН уменьшается;
в) концентрация ионов ![]() уменьшается;
уменьшается;
г) концентрация ионов ![]() НЕ изменяется.
НЕ изменяется.
Укажите формулу соединения, которое вступает в реакции поликонденсации:
Укажите схему реакции дегидрирования:
Аминоуксусная кислота взаимодействует с веществами, формулы которых (электролиты взяты в виде водных растворов):
а) 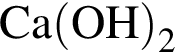 б)
б) 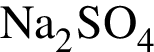 в)
в) 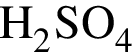 г)
г) ![]()
1) а, б
2) а, в, г
3) б, г
4) а, в
Выберите три утверждения, верно характеризующие глицин.
| 1 | является гомологом аланина |
| 2 | реагирует с бромоводородной кислотой |
| 3 | НЕ реагирует с гидроксидом бария |
| 4 | в лаборатории получают из анилина |
| 5 | является продуктом кислотного гидролиза белков |
| 6 | кристаллическое вещество (н. у.), хорошо растворимое в воде |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 123.
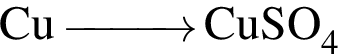
Укажите сумму молярных масс (г/моль) медьсодержащего вещества Г и органического вещества Д, образующихся в результате следующих превращений:
Для осуществления превращений по схеме
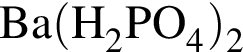 →
→ 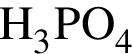 →
→ 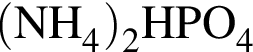 →
→ 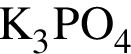 →
→ 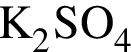
выберите реагенты из предложенных:
1 — 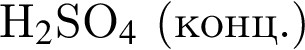
2 — ![]()
3 — 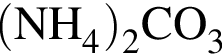
4 — ![]()
5 — 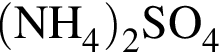
Ответ запишите цифрами в порядке следования превращений, например: 2443. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
Найдите сумму коэффициентов перед формулами углерода и фосфора в уравнении реакции, схема которой
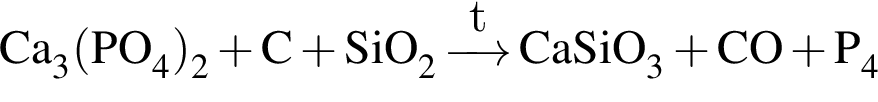
К раствору сульфата меди(II) массой 300 г с массовой долей 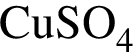 8% добавили медный купорос массой 80 г и перемешали смесь до полного его растворения. Рассчитайте массовую долю (%) соли в полученном растворе.
8% добавили медный купорос массой 80 г и перемешали смесь до полного его растворения. Рассчитайте массовую долю (%) соли в полученном растворе.
Дана схема превращений
Вычислите сумму молярных масс (г/моль) твёрдого при температура 20 °C неорганического вещества ![]() и органического вещества молекулярного строения
и органического вещества молекулярного строения ![]()
При прокаливании очищенного мела массой 220 кг получили 117 кг негашеной извести. Определите выход (%) продукта реакции.
Загрязненный образец соли 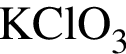 массой 22,28 г нагрели в присутствии катализатора до постоянной массы. При этом соль разложилась на хлорид калия и кислород, а масса образца уменьшилась на 7,68 г. Известно, что при нагревании не образовалось никаких посторонних веществ, а примеси не разлагались и не улетучивались. Вычислите массовую долю (%)
массой 22,28 г нагрели в присутствии катализатора до постоянной массы. При этом соль разложилась на хлорид калия и кислород, а масса образца уменьшилась на 7,68 г. Известно, что при нагревании не образовалось никаких посторонних веществ, а примеси не разлагались и не улетучивались. Вычислите массовую долю (%) 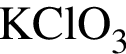 в исходном образце.
в исходном образце.
В стакан с водным раствором гидрокарбоната бария добавили негашеную известь и перемешали. После фильтрования смеси осталась чистая вода, а масса твердого остатка составила 53 г. Вычислите массу (г) добавленной извести. Ответ округлите до целых.
Для повышения устойчивости озон разбавили неоном. Полученная смесь объемом (н. у.) 42 дм3 имеет плотность 1,2 г/дм3. Рассчитайте максимальный объем (н. у., дм3) пропана, который можно полностью окислить данной смесью.
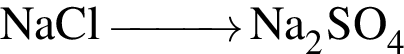
Для анализов смеси хлоридов натрия и аммония провели следующие операции. Навеску смеси массой 5г растворили в воде. К полученному раствору прибавили 300г раствора гидроксида калия с массовой долей ![]() 2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 150см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 150см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
Загрязненный аммиак объемом 32 м3 (н. у.) содержит 10% примесей (по объему). В результате поглощения всего аммиака избытком азотной кислоты была получена аммиачная селитра. Учитывая, что для подкормки одного плодового дерева необходимо 45 г химического элемента азота, рассчитайте, какое количество деревьев можно подкормить, используя полученную селитру.
Тепловой эффект реакции образования карбоната кальция из оксидов составляет 178 кДж/моль. Для полного разложения некоторого количества карбоната кальция потребовалось 44,5 кДж теплоты. Полученный оксид кальция спекали с углем массой 9,6 г в электропечи. Вычислите массу (г) образовавшегося при этом бинарного соединения, в котором массовая доля кальция равна 62,5%. (Примесями пренебречь.)
Электролиз водного раствора, содержащего хлорид калия массой 186,25 г, протекает по схеме
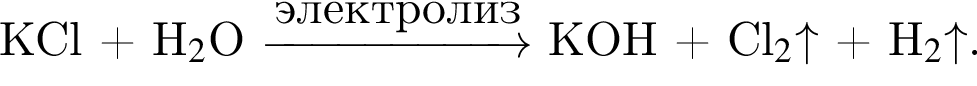
Рассчитайте объем (н. у., дм3) выделившегося в результате реакции хлора, если его выход составляет 64%.
Порцию кристаллогидрата соли 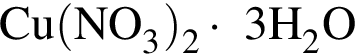 прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 8 дм3 имеет
прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 8 дм3 имеет ![]() Рассчитайте массу (г) черного порошка.
Рассчитайте массу (г) черного порошка.